El átomo es la unidad de materia más pequeña de un elemento químico que mantiene su identidad o sus propiedades, y que no es posible dividir mediante procesos químicos. Está compuesto por un núcleo atómico, en el que se concentra casi toda su masa, rodeado de una nube de electrones. El núcleo está formado por protones, con carga positiva, yneutrones, eléctricamente neutros.[nota 1] Los electrones, cargados negativamente, permanecen ligados a este mediante la fuerza electromagnética.
Los átomos se clasifican de acuerdo al número de protones y neutrones que contenga su núcleo. El número de protones o número atómico determina su elemento químico, y el número de neutrones determina su isótopo. Un átomo con el mismo número de protones que de electrones es eléctricamente neutro. Si por el contrario posee un exceso de protones o de electrones, su carga neta es positiva o negativa, y se denomina ion.
El nombre átomo proviene del latín atomum, y éste del griego ἄτομον, sin partes; también, se deriva de «a» (no) y «tomo» (divisible); no divisible.[1] El concepto de átomo como bloque básico e indivisible que compone la materia del universo fue postulado por la escuela atomista en la Antigua Grecia. Sin embargo, su existencia no quedó demostrada hasta el siglo XIX. Con el desarrollo de la física nuclear en el siglo XX se comprobó que el átomo puede subdividirse en partículas más pequeñas.[2] [3]
Los átomos son objetos muy pequeños con masas igualmente minúsculas: su diámetro y masa son del orden de la billonésima parte de un metro y cuatrillonésima parte de un gramo. Solo pueden ser observados mediante instrumentos especiales tales como unmicroscopio de efecto túnel. Más de un 99,94% de la masa del átomo está concentrada en su núcleo, en general repartida de manera aproximadamente equitativa entre protones y neutrones. El núcleo de un átomo puede ser inestable y sufrir una transmutaciónmediante desintegración radioactiva. Los electrones en la nube del átomo están repartidos en distintos niveles de energía u orbitales, y determinan las propiedades químicas del mismo. Las transiciones entre los distintos niveles dan lugar a la emisión o absorción deradiación electromagnética en forma de fotones, y son la base de la espectroscopía.
Propiedades atómicas
Masa
La mayor parte de la masa del átomo viene de los nucleones, los protones y neutrones del núcleo. También contribuyen en una pequeña parte la masa de los electrones, y la energía de ligadura de los nucleones, en virtud de la equivalencia entre masa y energía. La unidad de masa que se utiliza habitualmente para expresarla es la unidad de masa atómica (u). Esta se define como la doceava parte de la masa de un átomo neutro de carbono-12 libre, cuyo núcleo contiene 6 protones y 6 neutrones, y equivale a 1,66 · 10-27 kg aproximadamente. En comparación el protón y el neutrón libres tienen una masa de 1,007 y 1,009 u. La masa de un átomo es entonces aproximadamente igual al número de nucleones en su núcleo —el número másico— multiplicado por la unidad de masa atómica. El átomo estable más pesado es el plomo-208, con una masa de 207,98 u.[8]
En química se utiliza también el mol como unidad de masa. Un mol de átomos de cualquier elemento equivale siempre al mismo número de estos (6,022 · 1023), lo cual implica que un mol de átomos de un elemento con masa atómica de 1 u pesa aproximadamente 1 gramo. En general, un mol de átomos de un cierto elemento pesa de forma aproximada tantos gramos como la masa atómica de dicho elemento.
Tamaño
Los átomos no están delimitados por una frontera clara, por lo que su tamaño se equipara con el de su nube electrónica. Sin embargo, tampoco puede establecerse una medida de esta, debido a las propiedades ondulatorias de los electrones. En la práctica, se define elradio atómico estimándolo en función de algún fenómeno físico, como la cantidad y densidad de átomos en un volumen dado, o la distancia entre dos núcleos en una molécula.
Los diversos métodos existentes arrojan valores para el radio atómico de entre 0,5 y 5 Å. Dentro de la tabla periódica de los elementos, el tamaño de los átomos tiende a disminuir a lo largo de un periodo —una fila—, para aumentar súbitamente al comienzo de uno nuevo, a medida que los electrones ocupan niveles de energía más altos.[9]
Las dimensiones del átomo son miles de veces más pequeñas que la longitud de onda de la luz (400-700 nm) por lo que estos no pueden ser observados utilizando instrumentos ópticos. En comparación, el grosor de un cabello humano es equivalente a un millón de átomos de carbono. Si una manzana fuera del tamaño de la Tierra, los átomos en ella serían tan grandes como la manzana original.[10]
Niveles de energía
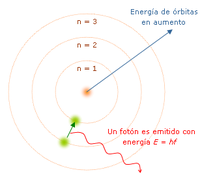
Un electrón ligado en el átomo posee una energía potencial inversamente proporcional a su distancia al núcleo y de signo negativo, lo que quiere decir que esta aumenta con la distancia. La magnitud de esta energía es la cantidad necesaria para desligarlo, y la unidad usada habitualmente para expresarla es el electrónvoltio (eV). En el modelo mecanocuántico solo hay un conjunto discreto de estados o niveles en los que un electrón ligado puede encontrarse —es decir, enumerables—, cada uno con un cierto valor de la energía. El nivel con el valor más bajo se denomina el estado fundamental, mientras que el resto se denominan estados excitados.
Cuando un electrón efectúa una transición entre dos estados distintos, absorbe o emite un fotón, cuya energía es precisamente la diferencia entre los dos niveles. La energía de un fotón es proporcional a su frecuencia, así que cada transición se corresponde con una banda estrecha del espectro electromagnético denominada línea espectral.
Cada elemento químico posee un espectro de líneas característico. Estas se detectan como líneas de emisión en la radiación de los átomos del mismo. Por el contrario, si se hace pasar radiación con un espectro de frecuencias continuo a través de estos, los fotones con la energía adecuada son absorbidos. Cuando los electrones excitados decaen más tarde, emiten en direcciones aleatorias, por lo que las frecuencias características se observan como líneas de absorción oscuras. Las medidas espectroscópicas de la intensidad y anchura de estas líneas permite determinar la composición de una sustancia.
Algunas líneas espectrales se presentan muy juntas entre sí, tanto que llegaron a confundirse con una sola históricamente, hasta que fue descubierta su subestructura o estructura fina. La causa de este fenómeno se encuentra en las diversas correcciones a considerar en la interacción entre los electrones y el núcleo. Teniendo en cuenta tan solo la fuerza electrostática, ocurre que algunas de las configuraciones electrónicas pueden tener la misma energía aun siendo distintas. El resto de pequeños efectos y fuerzas en el sistema electrón-núcleo rompe esta redundancia o degeneración, dando lugar a la estructura fina. Estos incluyen las correcciones relativistas al movimiento de electrón, la interacción de su momento magnético con el campo eléctrico y con el núcleo, etc.[11]
Además, en presencia de un campo externo los niveles de energía se ven modificados por la interacción del electrón con este, en general produciendo o aumentando la división entre los niveles de energía. Este fenómeno se conoce como efecto Stark en el caso de un campo eléctrico, y efecto Zeeman en el caso de un campo magnético.
Las transiciones de un electrón a un nivel superior ocurren en presencia de radiación electromagnética externa, que provoca la absorción del fotón necesario. Si la frecuencia de dicha radiación es muy alta, el fotón es muy energético y el electrón puede liberarse, en el llamado efecto fotoeléctrico.
Las transiciones a un nivel inferior pueden ocurrir de manera espontánea, emitiendo la energía mediante un fotón saliente; o de maneraestimulada, de nuevo en presencia de radiación. En este caso, un fotón «entrante» apropiado provoca que el electrón decaiga a un nivel con una diferencia de energía igual a la del fotón entrante. De este modo, se emite un fotón saliente cuya onda asociada está sincronizada con la del primero, y en la misma dirección. Este fenómeno es la base del láser.
Evolución del modelo atómico
La concepción del átomo que se ha tenido a lo largo de la historia ha variado de acuerdo a los descubrimientos realizados en el campo de la física y la química. A continuación se hará una exposición de los modelos atómicos propuestos por los científicos de diferentes épocas. Algunos de ellos son completamente obsoletos para explicar los fenómenos observados actualmente, pero se incluyen a manera de reseña histórica.
Modelo de Dalton
Fue el primer modelo atómico con bases científicas, fue formulado en 1808 por John Dalton, quien imaginaba a los átomos como diminutas esferas.[19] Este primer modelo atómico postulaba:
- La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
- Los átomos de un mismo elemento son iguales entre sí, tienen su propio peso y cualidades propias. Los átomos de los diferentes elementos tienen pesos diferentes.
- Los átomos permanecen sin división, aun cuando se combinen en las reacciones químicas.
- Los átomos, al combinarse para formar compuestos guardan relaciones simples.
- Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
- Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos.
Sin embargo desapareció ante el modelo de Thomson ya que no explica los rayos catódicos, la radioactividad ni la presencia de los electrones (e-) o protones(p+).
Modelo de Thomson
Luego del descubrimiento del electrón en 1897 por Joseph John Thomson, se determinó que la materia se componía de dos partes, una negativa y una positiva. La parte negativa estaba constituida por electrones, los cuales se encontraban según este modelo inmersos en una masa de carga positiva a manera de pasas en un pastel (de la analogía del inglés plum-pudding model) o uvas en gelatina. Posteriormente Jean Perrin propuso un modelo modificado a partir del de Thomson donde las «pasas» (electrones) se situaban en la parte exterior del «pastel» (la carga positiva).
Detalles del modelo atómico
Para explicar la formación de iones, positivos y negativos, y la presencia de los electrones dentro de la estructura atómica, Thomson ideó un átomo parecido a un pastel de frutas. Una nube positiva que contenía las pequeñas partículas negativas (los electrones) suspendidos en ella. El número de cargas negativas era el adecuado para neutralizar la carga positiva. En el caso de que el átomo perdiera un electrón, la estructura quedaría positiva; y si ganaba, la carga final sería negativa. De esta forma, explicaba la formación de iones; pero dejó sin explicación la existencia de las otras radiaciones.
Modelo de Rutherford
Este modelo fue desarrollado por el físico Ernest Rutherford a partir de los resultados obtenidos en lo que hoy se conoce como el experimento de Rutherford en 1911. Representa un avance sobre el modelo de Thomson, ya que mantiene que el átomo se compone de una parte positiva y una negativa, sin embargo, a diferencia del anterior, postula que la parte positiva se concentra en un núcleo, el cual también contiene virtualmente toda la masa del átomo, mientras que los electrones se ubican en una corteza orbitando al núcleo en órbitas circulares o elípticas con un espacio vacío entre ellos. A pesar de ser un modelo obsoleto, es la percepción más común del átomo del público no científico.
Rutherford predijo la existencia del neutrón en el año 1920, por esa razón en el modelo anterior (Thomson), no se habla de éste.
Por desgracia, el modelo atómico de Rutherford presentaba varias incongruencias:
- Contradecía las leyes del electromagnetismo de James Clerk Maxwell, las cuales estaban muy comprobadas mediante datos experimentales. Según las leyes de Maxwell, una carga eléctrica en movimiento (en este caso el electrón) debería emitir energía constantemente en forma de radiación y llegaría un momento en que el electrón caería sobre el núcleo y la materia se destruiría. Todo ocurriría muy brevemente.
- No explicaba los espectros atómicos.
Modelo de Bohr
Este modelo es estrictamente un modelo del átomo de hidrógeno tomando como punto de partida el modelo de Rutherford, Niels Bohr trata de incorporar los fenómenos de absorción y emisión de los gases, así como la nueva teoría de la cuantización de la energía desarrollada porMax Planck y el fenómeno del efecto fotoeléctrico observado por Albert Einstein.
«El átomo es un pequeño sistema solar con un núcleo en el centro y electrones moviéndose alrededor del núcleo en órbitas bien definidas». Las órbitas están cuantizadas (los e- pueden estar solo en ciertas órbitas)
- Cada órbita tiene una energía asociada. La más externa es la de mayor energía.
- Los electrones no radian energía (luz) mientras permanezcan en órbitas estables.
- Los electrones pueden saltar de una a otra órbita. Si lo hace desde una de menor energía a una de mayor energía absorbe un cuanto de energía (una cantidad) igual a la diferencia de energía asociada a cada órbita. Si pasa de una de mayor a una de menor, pierde energía en forma de radiación (luz).
El mayor éxito de Bohr fue dar la explicación al espectro de emisión del hidrógeno. Pero solo la luz de este elemento. Proporciona una base para el carácter cuántico de la luz, el fotón es emitido cuando un electrón cae de una órbita a otra, siendo un pulso de energía radiada.
Bohr no puede explicar la existencia de órbitas estables y para la condición de cuantización.
Bohr encontró que el momento angular del electrón es h/2π por un método que no puede justificar.
Modelo de Schrödinger
Después de que Louis-Victor de Broglie propuso la naturaleza ondulatoria de la materia en1924, la cual fue generalizada por Erwin Schrödinger en 1926, se actualizó nuevamente el modelo del átomo.
En el modelo de Schrödinger se abandona la concepción de los electrones como esferas diminutas con carga que giran en torno al núcleo, que es una extrapolación de la experiencia a nivel macroscópico hacia las diminutas dimensiones del átomo. En vez de esto, Schrödinger describe a los electrones por medio de una función de onda, el cuadrado de la cual representa la probabilidad de presencia en una región delimitada del espacio. Esta zona de probabilidad se conoce como orbital. La gráfica siguiente muestra los orbitales para los primeros niveles de energía disponibles en el átomo de hidrógeno.
Cuanto
En física, el término cuanto o cuantio (del latín Quantum, plural Quanta, que representa una cantidad de algo) denotaba en la física cuántica primitiva tanto el valor mínimo que puede tomar una determinada magnitud en un sistema físico, como la mínima variación posible de este parámetro al pasar de un estado discreto a otro. Se hablaba de que una determinada magnitud estaba cuantizada según el valor de cuanto. Es decir, cuanto es una proporción hecha por la magnitud dada.
Un ejemplo del modo en que algunas cantidades relevantes de un sistema físico están cuantizadas lo encontramos en el caso de lacarga eléctrica de un cuerpo, que sólo puede tomar un valor que sea un múltiplo entero de la carga del electrón. En la moderna teoría cuántica aunque se sigue hablando de cuantización el término cuanto ha caído en desuso. El hecho de que las magnitudes estén cuantizadas se considera ahora un hecho secundario y menos definitorio de las caracterísitcas esenciales de la teoría.
En informática, un cuanto de tiempo es un pequeño intervalo de tiempo que se asigna a un proceso para que ejecute sus instrucciones. El cuanto es determinado por el planificador de procesos utilizando algún algoritmo de planificación. Y los definió Max Plank.
El ejemplo clásico de un cuanto procede de la descripción de la naturaleza de la luz, como la energía de la luz está cuantizada, la mínima cantidad posible de energía que puede transportar la luz sería la que proporciona una partícula subatómica.